Introduction
L’immunohistochimie (IHC) constitue aujourd’hui le gold standard pour la détection d’antigènes tissulaires en anatomopathologie. En mobilisant des anticorps spécifiques pour révéler des protéines d’intérêt, elle joue un rôle central dans le diagnostic d’un large éventail de pathologies, notamment en oncologie, où elle contribue à la classification tumorale, à l’identification du site primitif et à l’orientation thérapeutique via l’évaluation de biomarqueurs1.
Depuis ses premières applications rapportées dans les années 19402, l’IHC s’est imposée comme une méthode essentielle, tant en pratique clinique qu’en recherche translationnelle. Elle intervient par exemple dans l’étude des récepteurs hormonaux en pathologie mammaire, dans l’identification d’agents infectieux ou dans la caractérisation de marqueurs associés à la réponse thérapeutique.
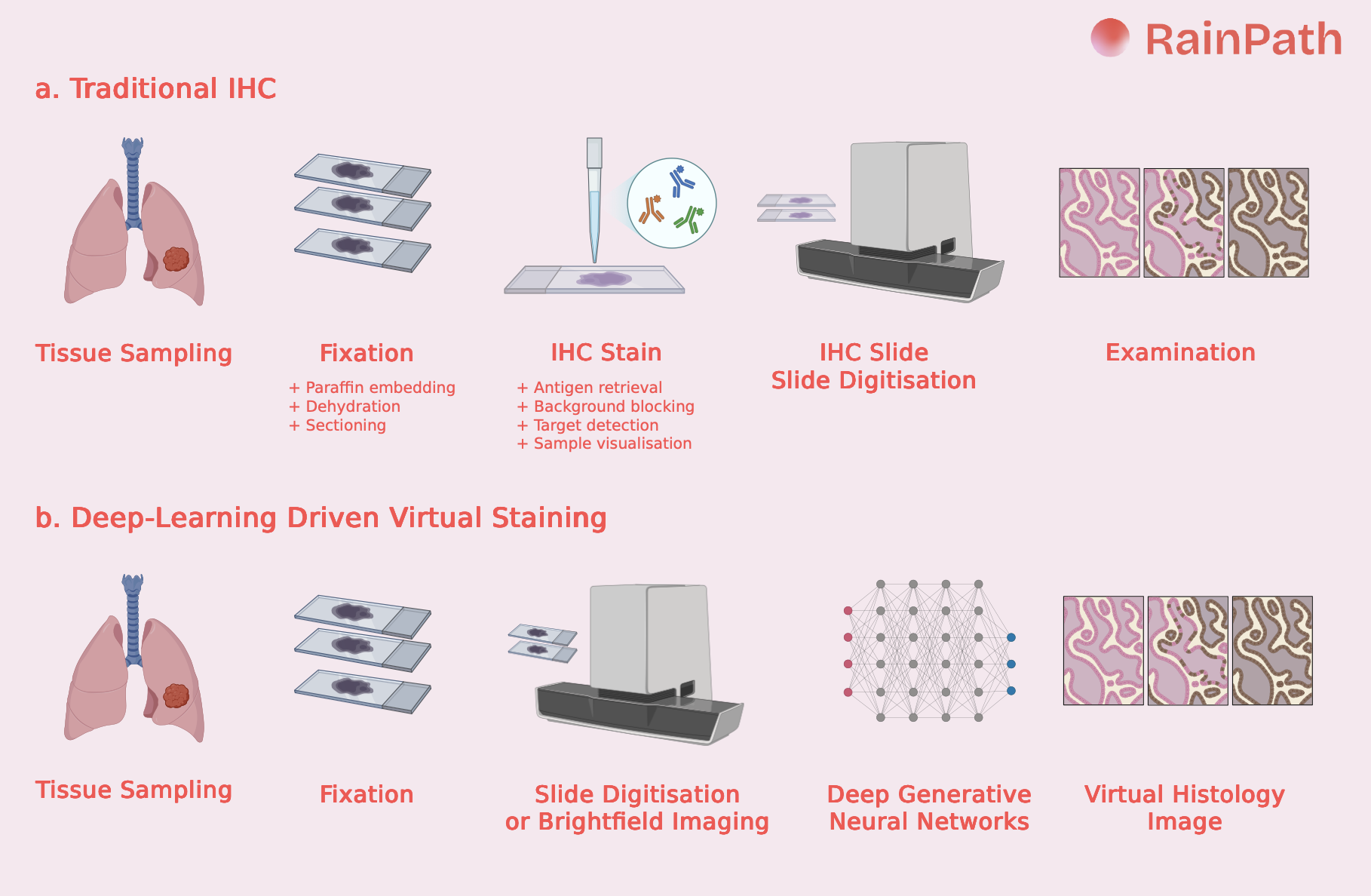
L’IHC conventionnelle consiste à colorer de fines sections tissulaires montées sur lame. Le processus comprend plusieurs étapes successives, comme illustré en fig.1a. Bien que les plateformes automatisées (Roche Ventana, Dako/Agilent, Leica Biosystems) aient permis d’améliorer la standardisation et le débit dans de nombreux laboratoires hospitaliers, le workflow global reste très consommateur de temps et de ressources humaines. Le délai entre l’échantillon initial et le compte rendu diagnostique peut atteindre plusieurs jours, notamment dans les laboratoires à haut volume.
Ce constat est particulièrement préoccupant dans un contexte international marqué par une réduction des effectifs d'anatomopathologistes et de techniciens spécialisés, et par une demande croissante d’IHC liée à la médecine de précision. Même avec les avancées en pathologie numérique (scanners de lames, nouveaux IMS), la coloration demeure un goulot d’étranglement majeur.
Depuis 2019, une nouvelle technologie ouvre la porte à l’ère optique : le virtual staining. Décrite par Rivenson et al.3, cette approche repose sur des réseaux neuronaux génératifs entraînés et validés sur des milliers de whole slide images (WSI), capables de produire numériquement des images équivalentes à une IHC à partir d’un tissu non coloré ou d’une lame H&E/HES. Le procédé (fig.1b) réduit considérablement le temps de manipulation, la consommation de réactifs et les coûts. En remplaçant une étape à la fois longue et consommatrice de ressources, le virtual staining constitue une voie prometteuse vers une pathologie plus efficace, scalable, reproductible et durable.
Turnaround Time
Les délais d’exécution de l’IHC varient selon les laboratoires, le type et le nombre de biomarqueurs analysés, ainsi que selon la nécessité éventuelle de réaliser des analyses complémentaires (comme la FISH). Ici, seuls les délais relatifs à l’IHC sont considérés.
En France, les hôpitaux publics rapportent des durées de coloration comprises entre 24 et 72 heures, selon le type d’échantillon. De manière générale, les comptes rendus intégrant une IHC sont disponibles en 1 à 3 jours ouvrés, même si les demandes complexes ou multimarqueurs peuvent prolonger ce délai jusqu’à près d’une semaine. Les durées varient également en fonction du type d’anticorps et de l’organisation interne de chaque laboratoire4,5,6.
Le virtual staining permet de générer une image équivalente IHC en quelques secondes à partir d’une lame H&E, ou en moins d’une minute à partir d’un tissu non coloré via des modèles d’IA label-free7. Cette réduction d’échelle, passée de plusieurs jours à moins d’une minute, modifie profondément la dynamique du workflow diagnostique et peut contribuer à diminuer les délais de prise en charge des patients.
Coût par échantillon
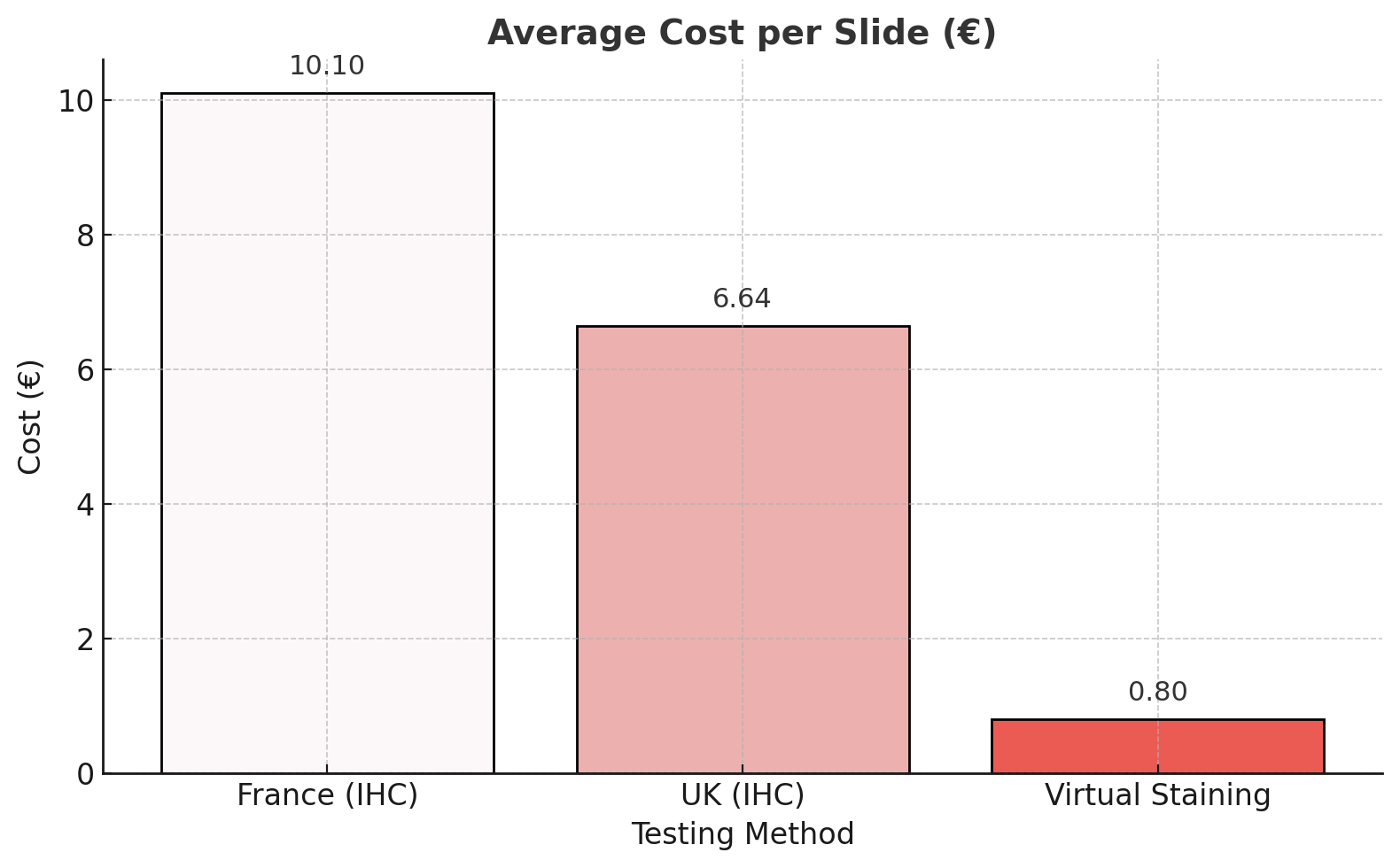
Le coût d’un examen IHC comprend des composantes fixes (équipements, maintenance, salaires des techniciens) et des composantes variables, dominées par le type d’anticorps utilisé et son fournisseur. En France, la tarification de l’IHC est encadrée par des référentiels nationaux. La facturation dépend du nombre de marqueurs, et en pratique, la réalisation d’un seul test IHC coûte au laboratoire entre 5 et 30 €, pour une moyenne de 10,10 € (fig.2)8,9. Les différences de coût entre les hôpitaux publics et les laboratoires privés conventionnés sont minimes.
Au Royaume-Uni, les hôpitaux du NHS ne publient pas directement les coûts internes de l’IHC. Cependant, les données comptables du Manchester University NHS Foundation Trust10, 11,12 permettent d’en estimer le coût réel. En rapportant les dépenses totales liées à l’IHC au nombre de cas traités sur la même période, le coût moyen par lame est d’environ £5.82, soit 6,64 € (fig. 2), avec des valeurs pouvant atteindre £32.4 (soit 36,94 €) selon l’anticorps utilisé.
Le virtual staining permet de réduire encore davantage ces coûts, principalement grâce à l’élimination totale des anticorps, qui représentent la part la plus coûteuse de l’IHC. D’après nos données internes, la génération virtuelle d’un marquage Ki-67 à partir d’une lame H&E coûte environ 0,10 € par lame (coloration virtuelle seule), un coût qui reste stable même lorsque plusieurs biomarqueurs sont produits en parallèle. Lorsqu’on y ajoute les autres composantes (frais généraux, salaires techniciens, consommables, amortissement et maintenance), le coût total atteint environ 0,80 € par lame. Malgré les variations locales possibles (coût du travail, infrastructures), cette valeur représente une diminution substantielle, ramenant le coût par lame virtuellement colorée à moins d’un dixième du coût de l’IHC conventionnelle, en France comme au Royaume-Uni.
Discussion et conclusion
À l’échelle mondiale, les services d’anatomopathologie sont confrontés à un défi majeur : une réduction de l’effectif d’anatomopathologistes, il est estimé que plus de 4 000 pathologistes supplémentaires seront nécessaires aux États-Unis d’ici 2037, avec des tendances similaires au Royaume-Uni, en France et dans d’autres systèmes de santé12, 14. Cette contraction des effectifs survient au moment même où la demande d’IHC augmente, portée par le vieillissement de la population et par l’incidence croissante des pathologies nécessitant une caractérisation structurelle fine.
Si la digitalisation via les systèmes de gestion de laboratoire (SGL), les scanners et les automates de coloration a permis d’améliorer l’efficacité des workflows, elle n’a pas permis de résoudre le principal goulot d’étranglement : l’étape de coloration IHC, qui reste manuelle, dépendante des réactifs et consommatrice de ressources. Cette étape explique en grande partie les délais prolongés et les coûts élevés observés en routine. Sur le long terme, l’écart de coût observé entre la France et le Royaume-Uni reflète notamment des différences structurelles d’organisation et de standardisation des procédés.
Dans ce contexte, le virtual staining constitue une piste très prometteuse. En diminuant l’utilisation de réactifs, en réduisant les délais et en limitant les besoins en personnel, cette technologie contribue également à une meilleure cohérence des résultats et à une reproductibilité accrue, tout en s’inscrivant dans une démarche de durabilité. Les études préliminaires et validations initiales montrent un potentiel important. Les futures étapes devront inclure des essais cliniques robustes et des référentiels standardisés. Les métriques portant sur la qualité d’image, la précision au niveau pixel et la similarité structurelle seront essentielles pour évaluer les performances.
Une fois ces validations effectuées, le virtual staining pourra être déployé à grande échelle, permettant d’alléger la charge des laboratoires tout en soutenant le développement de la pathologie de précision.
Dans certains systèmes de remboursement, son adoption pourrait également réduire les dépenses publiques liées aux actes diagnostiques.
En conclusion, l’IHC reste un pilier du diagnostic, mais l’augmentation de la demande en révèle les limites, tant en termes de coûts que de délais. En France, les durées classiques sont de 1 à 3 jours, pour un coût de 5 à 30 € par lame (jusqu’à 36,94 € dans certains cas). Le virtual staining permettrait de ramener ce délai à moins d’une minute et ce coût à moins de 1 €, constituant une avancée majeure en matière d’efficacité et d’accessibilité.
Chez RainPath, nous développons des solutions de virtual staining basées sur l’IA pour aider les anatomopathologistes à gagner du temps, réduire les coûts, et se concentrer sur l’interprétation diagnostique. Nous sommes ouverts aux collaborations académiques et cliniques visant à explorer, valider et faire progresser cette innovation.
Références
1. Mebratie DY, Dagnaw GG. Review of immunohistochemistry techniques: Applications, current status, and future perspectives. Semin Diagn Pathol. 2024 May;41(3):154–160. doi:10.1053/j.semdp.2024.05.001.
2. Coons AH, Creech HJ, Jones RN, Berliner E. The demonstration of pneumococcal antigen in tissues by the use of fluorescent antibody. J Immunol. 1942 Nov;45(3):159–170. doi:10.4049/jimmunol.45.3.159.
3. Rivenson Y, Wang H, Wei Z, et al. Virtual histological staining of unlabelled tissue-autofluorescence images via deep learning. Nat Biomed Eng. 2019;3:466–477. doi:10.1038/s41551-019-0362-y.
4. Association française des assistants en pathologie. Foire aux questions [Internet]. Paris: Anapath.fr; [cited 2025 Oct 29]. Available from: https://www.anapath.fr/foire-aux-questions/
5. Centre National de Dermatopathologie (CND) – La Roquette. Manuel de prélèvement [Internet]. Paris: CND; 2022 Jul [cited 2025 Oct 29]. Available from: https://www.c-n-d.fr/wp-content/uploads/2022/07/CND-la-Roquette-manuel-prelevement_juillet2022.pdf
6. Unilabs France. Marqueurs d’immuno-histochimie [Internet]. Paris: Unilabs France; [cited 2025 Oct 29]. Available from: https://pathologie.unilabs.fr/sites/default/files/inline-files/Leaflet-marqueurs-immuno_05-05.pdf
7. Bai B, Yang X, Li Y, Zhang Y, Pillar N, Ozcan A. Deep learning-enabled virtual histological staining of biological samples. Light Sci Appl. 2023 Mar 3;12(1):57. doi: 10.1038/s41377-023-01104-7.
8. IHP Group. Catalogue des examens – Nantes [Internet]. Nantes (France): IHP Group; 2023 Apr [cited 2025 Oct 29]. Available from: https://ihp-group.fr/wp-content/uploads/2024/11/nantes_catalogue_des_examens.pdf
9. Vergara R. Revue et Analyse de la Pertinence des Investigations Anatomopathologiques Techniques (étude RAPIAT) - Analyse coût-efficacité pour le juste soin économique et écologique en Anatomie et Cytologie Pathologiques.
10. University Hospitals of North Midlands NHS Trust. FOI request ref 029-2021: Definitions – histopathology (including routine immunohistochemistry) [Internet]. Stafford: UHNM NHS Trust; 2020 May [cited 2025 Oct 29]. Available from: https://www.uhnm.nhs.uk/media/tmzc2mhu/20200518-foi-request-ref-029-2021-final-2-of-2.pdf
11. Đorđević M, Životić M, Radojević Škodrić S, Nešović Ostojić J, Marković Lipkovski J, Filipović J, et al. Effects of Automation on Sustainability of Immunohistochemistry Laboratory. Healthcare. 2021 July 8;9(7):866. doi: 10.3390/healthcare9070866
12. Walsh E, Orsi NM. The current troubled state of the global pathology workforce: a concise review. Diagn Pathol. 2024 Dec 21;19(1):163. doi: 10.1186/s13000-024-01590-2
13. Manchester University NHS Foundation Trust. What we spend [Internet]. Manchester: MFT; [cited 2025 Oct 31]. Available from: https://mft.nhs.uk/the-trust/other-departments/procurement-e-commerce-department/what-we-spend/
14. Medicus Healthcare Solutions. The shrinking pathologist workforce: What’s driving the shortage? [Internet]. Windham (NH): Medicus Healthcare Solutions; 2025 Sep 18 [cited 2025 Oct 29]. Available from: https://medicushcs.com/resources/the-shrinking-pathologist-workforce-whats-driving-the-shortage
Abonnez-vous à notre newsletter
Suivez nos dernières publications en pathologie digitale



.svg.png)